Bảng tuần hoàn hóa học và mẹo nhớ lâu
Bảng tuần hoàn, tên đầy đủ là Bảng tuần hoàn các nguyên tố hóa học, còn được biết với tên Bảng tuần hoàn Mendeleev, là một phương pháp liệt kê các nguyên tố hóa học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng.
Các nguyên tố được biểu diễn theo trật tự số hiệu nguyên tử tăng dần, thường liệt kê cùng với ký hiệu hóa học trong mỗi ô. Dạng tiêu chuẩn của bảng gồm các nguyên tố được sắp xếp thành 18 cột và 7 dòng, với hai dòng kép nằm riêng nằm bên dưới cùng.
Xem thêm: Diện tích hình bình hành, cách tính chính xác nhanh nhất
Bảng tuần hoàn và nguyên tố hóa học Mendeleev
Với bảng tuần hoàn các nguyên tố hóa học là cách thức hiện thị dạng bảng các nguyên tố hóa học do nhà hóa học Dimitri Mendeleev người Nga phát minh vào năm 1869. Ông phát minh là bảng để sắp xếp chu ký các nguyên tố hóa học, đễ nhận biết và co quy luật dễ học hơn. Bố cục của bảng tuần hoàn hóa học đã được tinh chỉnh và mở rộng dần theo thời gian khi mà các nguyên tố dần được phát hiện. Tuy nhiên, các hình thức hiển thị cơ bản vẫn khá giống với thiết kế ban đầu của Mendeleev.
Các nguyên tố nhẹ nhất là hydro (có ba loại nguyên tử là hydro, Đơteri và triti), là những nguyên tố đầu tiên xuất hiện trong Vụ Nổ Lớn (the Big Bang). Tất cả các nguyên tố nặng hơn được tìm thấy hay sản xuất một cách tự nhiên hay nhân tạo thông qua hàng loạt phương thức khác nhau.
Xem thêm: Bảng cửu chương ( Cách học nhanh cho bé, phát triển tư duy )
Bảng hệ thống tuần hoàn hóa học
Trong nghiên cứu, giảng dạy và học tập hoá học thì bảng tuần hoàn (hay hệ thống tuần hoàn) các nguyên tố hoá học là một công cụ rất cần thiết. Có nhiều dạng bảng tuần hoàn khác nhau như bảng tuần hoàn dạng bậc thang, bảng tuần hoàn dạng quạt xoè, bảng tuần hoàn dạng múi nhưng phổ biến nhất là bảng tuần hoàn dạng ô (có hai loại bảng dài và bảng ngắn). Ở bài này chúng ta sẽ nghiên cứu bảng tuần hoàn dạng ô dài.
Cách xem bảng tuần hoàn hóa học
Để sử dụng bảng tuần hoàn hóa học một cách dễ dàng, dễ nhớ bạn cần chú ý đến những thành phần sau đây:
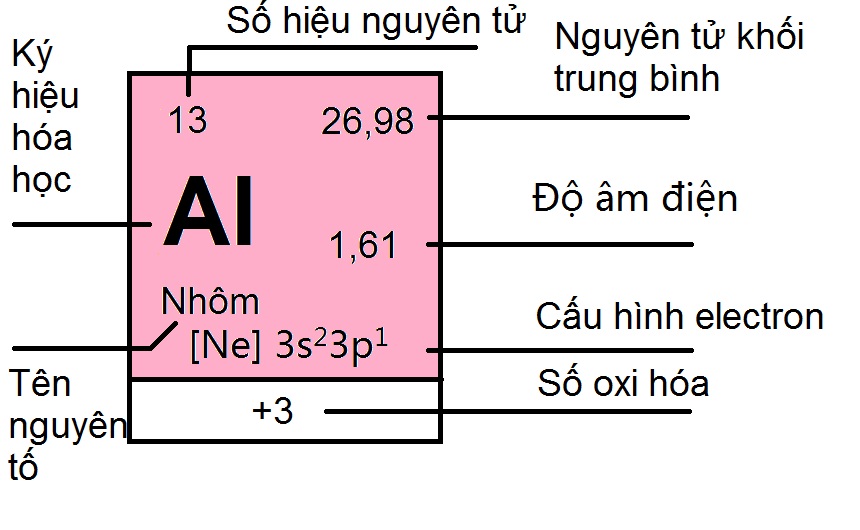
– Số nguyên tử: Số nguyên tử hay số proton của 1 nguyên tố hóa học là số proton được tìm thấy trong hạt nhân của 1 nguyên tử. Nó chính là số điện tích của hạt nhân. Số nguyên tử giúp xác định duy nhất một nguyên tố hóa học. Trong một nguyên tử không tích điện, số nguyên tử cũng bằng số electron.
– Nguyên tử khối trung bình: Gần như các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định Suy ra nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử tương ứng.
– Độ âm điện: Độ âm điện của 1 nguyên tử là khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học. Vì thế độ âm điện của nguyên tử nguyên tố càng lớn thì tính phi kim nguyên tố đó càng mạnh và ngược lại, độ âm điện của nguyên tử nguyên tố càng nhỏ thì tính kim loại càng mạnh
– Cấu hình Electron: Cấu hình electron, cấu hình điện tử, nguyên tử cho biết sự phân bố các electron trong lớp vỏ nguyên tử ở các trạng thái năng lượng khác nhau hay ở các vùng hiện diện của chúng
– Số Oxi hóa: Số oxi hóa là số áp cho một nguyên tử hay nhóm nguyên tử.Nhờ số oxi háa này chúng ta có thể nhận biết được số electron được trao đổi khi một chất bị oxi hóa hoặc bị khử trong một phản ứng
– Tên nguyên tố: Nguyên tố hóa học,hay được gọi đơn giản là nguyên tố, là 1 chất hóa học tinh khiết, bao gồm 1 kiểu nguyên tử, được phân biệt bởi số hiệu nguyên tử, là số lượng proton có trong mỗi hạt nhân
– Ký hiệu hóa học: Trong hóa học, ký hiệu là tên viết tắt của một nguyên tố hóa học đó. Biểu tượng cho các nguyên tố hóa học thường bao gồm 1 hoặc 2 chữ cái trong bảng chữ cái Latinh và được viết với chữ cái đầu tiên viết hoa.
Cách ghi nhớ bảng tuần hoàn hóa học
Để ghi nhớ bảng tuần hoàn hóa học, khi làm bài kiểm tra hay trong các thí nghiệm hóa học bạn có hai cách nhớ nhanh chúng tôi sẽ liệt kê dưới đây.
Nghiên cứu bảng tuần hoàn:
Xác định bản chất các thành phần khác nhau của mỗi nguyên tố hóc học, trong bảng tuần hoàn hóa học, mỗi một ô sẽ gồm nguyên tố cùng các thuộc tính, thành phần của nguyên tố đó. Vì vậy, để tìm hiểu bảng tuần hoàn, bạn cần biết tên nguyên tố cùng ký hiệu hóa học, số nguyên tử… Tất cả các thông tin này đều có trong ô nguyên tố đó.
Hãy học bảng tuần hoàn hóa học với mười nguyên tố đầu tiên bên trong bảng. Khi nhớ và thành thạo các nguyên tố này, bạn học cách suy diễn các giá trị nguyên tố tiếp theo. Sau đó, bạn sử dụng phương phát so sánh với giá trị đã học. Cứ như vậy, bạn sẽ học hết hơn 120 nguyên tố trong bảng tuần hoàn Mendeleev.
Bạn có thể in học mua một bản tuần hoàn, bạn sẽ mang đi mọi nơi và học bất cứ khi nào thuận tiện. Hãy in thật nhiều bản và dán những nơi cần thiết trong không gian học. Hãy gim một tờ note trên bản dán nhiều lúc bạn phải ghi nhớ.
Thời buổi công nghệ học bảng tuần hoàn có vẽ rất là dễ dàng, bạn hãy chụp lại bản chính và để ở nơi bạn hay vô nhất. Thường xuyên mở ra xem để nhớ được lâu hơn.
Thay vì nhồi nhét quá nhiều nguyên tố bạn có thể chia thành các phần nhỏ để học, sử dụng lối suy diễn theo nhóm bạn dễ dàng biết nguyên tố hóa trị mấy, có bao nhiêu E, và nó có khối lượng bao nhiêu.
Cách nhớ dãy kim loại bá đạo nhất: K Na Ca Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng áo phi âu.
Dùng phương pháp ghi nhớ bảng tuần hoàn
Dùng phương pháp nhớ là viết một vài cụm từ, một vài câu suôn miệng giúp bạn nhớ nhanh hơn trong các nguyên tố hóa học. Phương pháp nhớ nhanh và dài nhất là thường xuyên làm bài tập hóa học và tra bảng tuần hòa hóa học.
Cách làm nhanh và bạn trỏ thành một người giỏi hóa thực thụ là thường xuyên giải các bài tập về hóa học, tra và xem các nguyên tố hóa học. Thực hiện các phương pháp cân bằng hòa học cần thiết.
Tải ứng dụng nguyên tố hóa học về điện thoại và thường xuyên xem, kiểm tra trí nhớ bạn sẽ nhé rất chính xác qua hình ảnh củng như các nguyên tố.
1. Cách học thuộc hóa trị lớp 8
Hóa trị I: Hg, Ag, Na, Cl, K, Li. Đọc là: Hết Bạc Na Lo Kiếm Liền
Hóa trị II: Mg, Ca, Ba, Pb. Cu, Hg, Fe, Zn – đọc là: Má Cản Ba Phá Cửa Hàng Sắt Kẽm
Hóa trị III: Có Al và Fe
Hóa trị I là: Na, K, Ag, Cl.
Hóa trị III là: Al, Fe
Hóa trị II: Còn lại (với Fe có hóa trị II và III luôn).
Hoặc là học câu nói vui sau: Hai Bà Cả không Mua Chì Kẽm Sắt Cũng Mãi một Năm Ăn hết Khoảng ba Phen Vàng Nhưng Sắt Nhôm năm Phen bốn Chỉ
Cách học thuộc hóa trị của nguyên tố dễ dàng thì học sinh nên lấy những hợp chất của oxi để làm ví dụ sau đó xác định hóa trị của các nguyên tố khác.
Ví dụ cụ thể: Để xác định hóa trị của Fe và Na ta có thể lấy những oxit như Na2O, FeO, Fe2O3.
Ta làm như sau:
Ta biết nguyên tố Oxi luôn luôn có hóa trị II
x II
Na2 O
Na2O sau khi viền xong rồi ta áp dụng công thức sau:
x II
a b
Ax = By
a.x b.y
Na2O x.2
x II
II .1 (ở đây ta xem số La Mã như số thường và nhân chia như bình thường nhé)
Na2O x.2
II .1 2.x 2
x 1.
Vậy hóa tri của Na: I
2. Cách học thuộc hóa trị lớp 8 theo số hóa trị của nguyên tố

Chúng ta nên nhớ là hóa trị phải ghi bằng chữ số La Mã. Tương tự như vậy đối với các hợp chất khác.
Hóa trị thì học theo nhóm cho dễ:
Nhóm có 1 hóa trị:
Bao gồm nhóm hóa trị I, II, III, IV
Hóa trị I bao gồm: H, Li, F, Na, Cl, K, Ag, Br
Hóa trị II bao gồm: Be, O, Mg, Ca, Zn, Ba, Hg
Hóa trị III bao gồm: B, Al
Hóa trị IV bao gồm: Si
Nhóm có nhiều hóa trị bao gồm:
Cacbon: IV, II
Chì: II, IV
Crom: III, II
Nito: III, II, IV
Photpho: III, V
Lưu huỳnh: IV, II, VI
Mangan: IV, II, VII…….Các hóa trị in đậm thường sử dụng nhiều nhất trong khi học.
Có 5 nhóm cần thuộc hóa trị bảng trang 42 SGK Hóa học 8 các em cần học thuộc
Hóa trị của các gốc gồm nhiều nguyên tố hóa học:
Các gốc hóa trị I gồm: OH (hidroxit ), NO3 (nitrat)
Các gốc hóa trị II gồm: CO3 ( cacbonat ), SO4 (sunfat)
Các gốc hóa trị III gồm: PO4 (photphat)
Bài tập áp dụng luyện tập cách học thuộc hóa trị lớp 8
- Bài tập áp dụng luyện tập cách học thuộc hóa trị lớp 8
Bài tập tìm công thức hóa học của hợp chất biết hóa trị
B1: Viết Công thức hóa học chung
B2: Theo quy tắc hóa trị:
a.x = b.y
=>Tìm giá trị của chỉ số
Chọn x = b’; y = a’, suy ra Công thức hóa học đúng.
Chú ý: Nếu một nhóm nguyên tử thì phải xem như một nguyên tố và lập Công thức hóa học như một nguyên tố khác.
Khi viết hóa trị phải viết theo số La Mã, còn chỉ số là số tự nhiên.
Yêu cầu: Để lập được CTHH của hợp chất bắt buộc nắm chắc kí hiệu hóa học và hóa trị của các nguyên tố tạo nên hợp chất đó.
* Hoặc nhớ mẹo hóa trị một số nguyên tố thường gặp như sau:
Hóa trị I là: K Na Ag H Br Cl
Khi Nàng Ăn Hắn Bỏ Chạy
Hóa trị II là: O Ba Ca Mg Zn Fe Cu
Ông Ba Cần May Zap Sắt Đồng
Hóa trị III là: Al Fe
Anh Fap
Đối với nguyên tố có nhiều hóa trị thì đề sẽ cho hóa trị ta chỉ làm theo thôi.
Ví dụ 1
Lập Công thức hóa học của hợp chất:
- a) Nhôm oxit được tạo nên tử 2 nguyên tố oxi và nhôm Al
Lời Giải
Theo quy tắc hóa trị ta có:
x . III = y . II
=> x = 2; y = 3
Vậy Công thức hóa học: Al2O3
- b) Cacbon đioxit gồm C(IV) và O (II)
Lời Giải
Theo quy tắc hóa trị ta có:
x . IV = y . II
=> x = 1; y = 2
Vậy Công thức hóa học: CO2
- b) Natri photphat gồm Na (I) và PO4(III)
Giải
Theo quy tắc hóa trị ta có:
x . I = y . III
=> x = 3; y = 1
Vậy Công thức hóa học: Na3PO4
Viết Công thức hóa học hoặc lập nhanh Công thức hóa học: Không cần làm theo từng bước cụ thể như trên, mà chỉ cần nắm rõ quy tắc chéo: Hóa trị của nguyên tố này sẽ là chỉ số của nguyên tố kia và ngược lại (với điều kiện rằng các tỉ số phải tối giản trước).
Chú ý: Nếu hai nguyên tố cùng hóa trị thì không cần ghi chỉ số (mặc định là 1 rồi)
Ví dụ
1) Viết công thức hóa học của hợp chất tạo bởi S (VI) và O.
=> Công thức hóa học SO3
(Do VI / II = 3/1 nên chéo xuống chỉ số của S là 1 còn O là 3).
2) Viết công thức hóa học của Fe(III) và SO4 hóa trị (II)
Công thức hóa học Fe2(SO4)3
(Lí giải: Tỉ lệ hóa trị III và II không cần tối giản, hóa trị III của Fe trở thành chỉ số 3 của SO4, như vậy phải đóng ngoặc nhóm SO4, hiểu là có 3 nhóm SO4. Hóa trị II của SO4 trở thành chỉ số 2 của Fe.)
Chú ý: Khi đã thành thạo, nắm rõ quy tác chúng ta có thể không cần viết hóa trị lên trên đỉnh nguyên tố, nhóm nguyên tử.
- Bài tập áp dụng luyện tập cách học thuộc hóa trị lớp 8 (Kèm lời giải)
Bài tập 1
Lập công thức hóa học của các hợp chất với hidro của các nguyên tố dưới đây:
- a) N (III) b) C (IV) c) S (II) d) Cl
Chú ý: a, b viết H đứng sau nguyên tố N, C.
c, d viết H đứng trước nguyên tố S và Cl.
Bài tập 2
Lập công thức hóa học cho các hợp chất:
- Cu(II) và Cl
- NH4(I) và SO4
- Al và NO3
- Ca và PO4
- Mg và O
- Fe(III) và SO4
Bài tập 3
Lập công thức hóa học của các hợp chất:
- Al và PO42. Na và SO4 3. Fe (II) và Cl
- Mg và CO35. Hg (II) và NO36. Zn và Br
- K và SO38. Na và Cl 9. Na và PO4
- Ba và HCO3(I) 11.K và H2PO4(I) 12.Na và HSO4(I)
Bài tập 4
Lập công thức hóa học hợp chất.
1/Lập CTHH hợp chất tạo bởi nhóm NO3 và nguyên tố Al. Cho biết ý nghĩa CTHH trên.
2/ Lập CTHH hợp chất phân tử gồm: Ba và SO4. Cho biết ý nghĩa CTHH trên.
3/Lập CTHH hợp chất có phân tử gồm nguyên tố Mg và nhóm OH. Cho biết ý nghĩa CTHH trên.
Bài tập 5
Viết CTHH của các hợp chất với lưu huỳnh (II) của các nguyên tố sau đây:
- a) K (I) b) Fe (II) c) Al (III) d) Hg (II)
Bài tập 6
Viết CTHH và tính phân tử khối của các hợp chất sau:
- a) Điphotpho pentaoxit gồm P(V) và O.
- b) Axit sunfuric gồm H và SO4.
- c) Bari cacbonat gồm Ba và CO3.
- d) Canxi photphat gồm Ca và PO4.
Bài 8 (*)
Xét các CTHH: Z(NO3)3; (NH4)3T; X2SO4; H2Y;. Biết hóa trị của SO4 là II, NH4 (I), NO3(I). Viết CTHH của hợp chất gồm:
- a) X và H b) Z và SO4c) T và H d) X và Y
- e) X và T f) Y và Z g) Z và T.


Bình luận